新闻 – 第 28 页 – 卫材(中国)药业有限公司-pg电子app
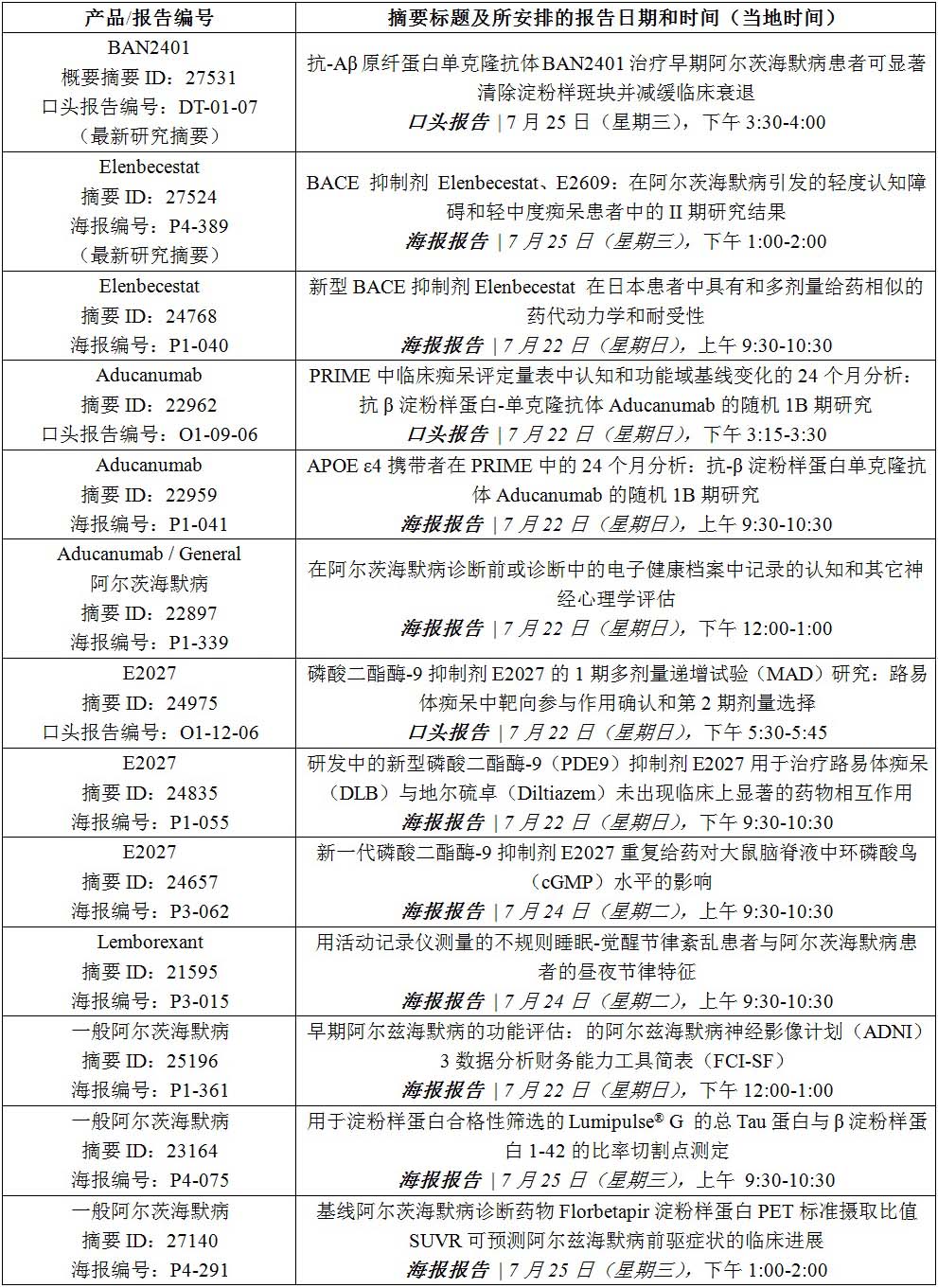
13份报告展示ban2401和elenbecestat的ii期研究结果
7月19日,卫材株式会社(总部位于日本东京,现任社长为内藤晴夫,以下简称”卫材”)宣布,于本年度在芝加哥举行的阿尔茨海默病协会国际会议(aaic)(会议时间:7月22日至26日)上发布13份报告。报告内容涉及抗-β淀粉样蛋白(aβ)原纤维抗体ban2401的ii期临床研究(201研究)结果、口服 bace(β淀粉样蛋白裂解酶)抑制剂elenbecestat(研发代码:e2609)的ii期临床研究(202研究)结果以及公司在阿尔茨海默病/痴呆症药品研发领域的最新数据:包括抗-aβ抗体 aducanumab。ban2401、elenbecestat和aducanumab由卫材和渤健(biogen)(总部位于美国马萨诸塞州剑桥市)共同研发。
按照7月10日发布的消息,卫材口头报告201研究(clinicaltrials.gov 标识号:nct01767311)中关于ban2401应用于早期阿尔茨海默病(由阿尔茨海默病引起的轻度认知障碍或轻度阿尔茨海默病性痴呆)治疗的最新概要。卫材和渤健(biogen)曾在7月6日宣布,201研究在18个月关键预定义终点的效果评估中,延缓病情发展(用阿尔茨海默病综合评分评估)中、减少大脑中淀粉样蛋白积累(用淀粉样蛋白-正电子发射断层造影术,即淀粉样蛋白-pet来评估)方面具有显著统计学意义。该研究是首个iib期研究数据中成功显示出其在临床功能上和大脑中β淀粉样蛋白积累方面的疾病修饰作用。研究中最常见的不良反应为输液反应和淀粉样蛋白相关影像异常(aria)。
同样,卫材用海报展示了有关elenbecestat最新研究的摘要,阐述202研究(clinicaltrials.gov 标识号nct02322021)中elenbecestat治疗由阿尔茨海默病引起的轻度认知障碍和轻、中度老年痴呆症的结果。2018年6月6日,卫材宣布,根据202研究18个月的阳性研究结果,elenbecestat的安全性和耐受性(主要终点)都在可接受范围。此外,用淀粉样蛋白-pet 测定其对大脑中aβ 水平的影响(探索性终点),结果具有显著统计学意义。另外,研究还显示该药可延缓一些功能性临床量表数据下降,且可能具有临床重要差异,尽管没有显著统计学意义。观察到的六种最常见不良反应为接触性皮炎、上呼吸道感染、头痛、腹泻、跌倒和皮炎。目前,正在早期阿尔茨海默病患者中进行两项elenbecestat的iii期临床研究(mission ad1/2)。
另外,渤健(biogen)正在进行针对aducanumab长期用药的ib期临床研究,在本次发布中进行了相关口头报告和海报展示。目前卫材和渤健(biogen)正在针对aducanumab进行两个iii期临床研究(engage/emerge)。
此外,此次发布还介绍了新型磷酸二酯酶-9抑制剂,包括一个i期临床研究结果的口头报告,及一些非临床性研究结果的海报展示。e2027由卫材独家研发,目前正在进行ii、iii期临床研究,作为路易体痴呆的潜在治疗。
睡眠-觉醒节律调节制剂lemborexant在不规律睡眠-觉醒节律障碍患者和阿尔茨海默病患者中进行的一项ii期临床研究(202研究)的基线数据也在aaic 2018上发布。lemborexant由卫材发现,自2015年8月起由卫材和普杜制药有限公司(purdue pharma l.p.,总部位于美国康涅狄格州,以下简称为”普杜”)共同开发。
基于30多年在阿尔茨海默病/痴呆领域的药物研发经验,卫材力求通过全盘的方法来研发痴呆药物以预防和治愈痴呆。卫材将尽快研发创新型药物,以满足患者及其家属的各种未被满足的医药需求,并提升他们的福祉。
阿尔茨海默病协会国际会议(aaic)2018报告内容:
请注意aaic 的禁播政策:在官方计划日期和发布时间之前,所有提交到aaic的材料都禁止出版和广播。
媒体咨询:
卫材株式会社
公共关系部
81-(0)3-3817-5120
[编者按]
1、关于 ban2401
ban2401是一种用于治疗阿尔茨海默病的人源化单克隆抗体,由卫材和bioarctic战略联盟共同研发。ban2401通过选择性结合来中和及消除可溶性、毒性aβ聚合物——这些物质被认为能够促进阿尔茨海默病的神经退行性进程。因此,ban2401可能对该病的病理具有潜在影响并可减缓该疾病的进展。根据卫材和bioarctic于2007年12月达成的协议,卫材获得授权在全球研究、开发、生产和销售用于治疗阿尔茨海默病的药物ban2401。
2、关于elenbecestat(通用名,研发代码:e2609)
elenbecestat是一种口服bace(β淀粉样蛋白裂解酶)抑制剂,由卫材发现可用于治疗阿尔茨海默病,目前处于iii期临床研究阶段。通过抑制bace这一产生aβ肽的关键酶,elenbecestat可减少aβ的产生,从而减少由于毒性寡聚物和原纤维在大脑中聚集而导致的淀粉样斑块的形成。目前正在进行两个关于elenbecestat用于治疗早期阿尔茨海默病的全球iii期临床研究(mission ad1/2)。此处早期阿尔茨海默病包括由阿尔茨海默病引起的轻度认知损害(mci)/阿尔茨海默病前驱期)及轻度阿尔茨海默病的早期阶段。此外,美国食品药品监督管理局(fda)已为elenbecestat的研发开通了快速通道。fda只对其认为具有治疗严重疾病并解决未被满足的医疗需求潜力的药物开放促进研发和加速评审的通道。
3、关于 aducanumab(biib037)
aducanuma是一种尚在研究阶段的、用于治疗阿尔茨海默病的化合药品,是通过反向转化医学(rtm)这一神经免疫技术平台获得,从无认知障碍健康老年受试者和具有异常缓慢认知衰退的障碍性老年受试者的去识别化b细胞文库中发现的一种人源重组单克隆抗体(mab)。在按照渤健(biogen)和neurimmune公司签订的《神经免疫合作开发和许可协议》,渤健(biogen)从neurimmune公司取得了aducanumab的研发和营销授权。aducanumab 靶向β淀粉样蛋白的聚集形式,包括可溶性低聚物和不溶性纤维。这两种物质可在阿尔茨海默病患者的大脑中形成淀粉样斑块。根据临床前和1b期数据,用aducanumab进行治疗可减少淀粉样斑块的水平。
2016年8月,aducanumab被纳入欧洲药品管理局的“prime”项目。2016年9月,美国食品药品监督管理局将aducanumab纳入其快速审评项目。2017年4月,aducanumab被纳入日本卫生、劳工与福利部的“sakigake”指定系统。
2017年10月,渤健(biogen)和卫材达成全球合作协议,共同研发和销售aducanumab。
4、关于卫材和渤健(biogen)治疗阿尔茨海默病的联合开发协议
卫材和渤健(biogen)在阿尔茨海默病治疗药物研发和商业化方面进行着广泛的合作。卫材在bace抑制剂 elenbecestat和抗- aβ原纤维抗体ban2401的联合研发方面处于主导地位,渤健(biogen)则在由该公司为阿尔茨海默病患者推出的抗- aβ抗体aducanumab的联合研发方面处于主导地位。两家公司计划在全球获得这三种药物的上市许可。如果这一申请获得批准,这两家公司将会在美国、欧盟和日本等主要市场上共同推广以上产品。
5、关于e2027
e2027是由卫材发现的一种选择性磷酸二酯酶(pde)9 抑制剂。抑制pde9可降低细胞间信号传递的关键物质——环磷鸟苷的降解。e2027 帮助维持大脑内的环磷鸟苷浓度,并有可能成为治疗路易体痴呆的新方案。
6、关于lemborexant(通用名,研发代码: e2006)
lemborexant是一种双食欲素受体拮抗剂,由卫材内部发现并研发。这一小分子化合物通过竞争性地结合两种亚型的食欲素受体(食欲素受体1和食欲素受体2)来抑制食欲素神经传递。患有睡眠障碍的人群体内调节睡眠和觉醒的食欲素系统无法正常运转。在正常睡眠期间,食欲素系统的活跃度被抑制,有可能会自觉阻止不正常觉醒,并通过干扰食欲素神经传递来促进睡眠开始和维持睡眠过程。因此,卫材和普渡一直在研发lemborexant来治疗多种睡眠障碍。
此外,一项关于lemborexant的ii期临床研究正在不规则的睡眠-觉醒节律紊乱(iswrd)和轻中度阿尔茨海默病痴呆患者中进行。
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)